L’article ci-dessous est une traduction d’une partie de publication de James Roguski, qui s’est longuement investi dans l’analyse de ce qui se passe à l’OMS. La publication est en anglais, très complète, contient un nombre de liens conséquent, à destination de qui veut prendre la peine de s’informer. Je ne reprends que le corps principal de l’article, simplement à titre indicatif pour illustrer l’image sacro-sainte de notre bien-aimée OMS.
Les produits approuvés, « préqualifiés » ou inscrits sur la liste d’urgence par l’Organisation mondiale de la santé sont-ils vraiment « sûrs et efficaces » ou s’agit-il simplement d’un autre racket de corruption et d’argent ?
Savez-vous que l’Organisation mondiale de la santé (OMS) a « préqualifié » 272 vaccins ? Elle demande plus de 100 000 dollars par vaccin !
Pour que les « produits liés à la santé » fassent partie du système d’approvisionnement des Nations unies, ils doivent être « préqualifiés » par l’OMS, qui perçoit des frais substantiels, uniques et continus, en échange de leur « préqualification ». (voir https://extranet.who.int/prequal/vaccines/fees-prequalification)
Un « racket » est défini comme l’acte de créer une demande pour un « service » par l’extorsion ou l’intimidation alors que ce « service » n’aurait pas été nécessaire autrement.
Un « racketteur » est une personne qui se livre à une activité criminelle organisée, généralement dans un but lucratif.
La pratique du « racket » est un type de crime organisé dans lequel les auteurs mettent en place un système ou une opération coercitive, frauduleuse, d’extorsion ou autrement coordonnée (un « racket ») afin d’engranger des bénéfices de manière répétée ou constante.
L’OMS est-elle éthiquement et financièrement responsable des dommages causés par les produits qu’elle « préqualifie » ?
Ou bien son système lucratif lui permet-il de créer une illusion de sécurité et d’efficacité tout en rejetant la responsabilité sur les agences nationales de réglementation responsables ?
Cliquez sur les liens ci-dessous pour plus de détails :
https://extranet.who.int/prequal/vaccines/fees-prequalification
https://extranet.who.int/prequal/vaccines/prequalified-vaccines
CLIQUEZ ICI pour télécharger le fichier de données CSV.
Si les fabricants veulent que leurs produits puissent être achetés par les agences des Nations unies, ils doivent se soumettre au système de l’Organisation mondiale de la santé pour que leurs produits soient « préqualifiés ».
QUELQUES EXTRAITS ÉVOCATEURS DE L’ACCORD PANDÉMIE ET DU RÈGLEMENT SANITAIRE INTERNATIONAL
L’« Accord sur les pandémies » proposé exigerait des nations qu’elles soutiennent l’influence croissante de l’Organisation mondiale de la santé sur le processus d’approbation des vaccins, des dispositifs d’immunisation, des médicaments catalogue, des diagnostics in vitro, des services d’inspection, des produits de lutte antivectorielle et, oui, même des dispositifs de circoncision masculine.
Article 14.5 de l’Accord Pandémie
Chaque partie, selon qu’il convient et conformément au droit applicable, encourage les concepteurs et fabricants concernés de produits de santé liés à la pandémie à rechercher avec diligence les autorisations et approbations réglementaires auprès des autorités réglementaires nationales et/ou régionales, y compris les autorités figurant sur la liste de l’OMS, ainsi que la préqualification de ces produits par l’OMS.
L’annexe 6 du Règlement sanitaire international stipule déjà ce qui suit (p.55)
1. Les vaccins et les produits prophylactiques désignés par l’OMS sont soumis à son approbation.
3. Les certificats délivrés au titre de la présente annexe ne sont valables que si le vaccin ou la prophylaxie utilisés ont été approuvés par l’OMS.
Un mot sur les financements et les tarifs divers …
Voir le lien à https://extranet.who.int/prequal/about/funding
L’Organisation mondiale de la santé fait payer très cher aux entreprises manufacturières la « préqualification » de leurs produits.
Les activités de préqualification de l’OMS ont longtemps été financées par des donateurs internationaux au moyen de subventions à court terme.
En janvier 2017, l’OMS a donc introduit un nouveau modèle de tarification pour les médicaments – produits pharmaceutiques finis (PPF) et ingrédients pharmaceutiques actifs (IPA) – et les vaccins, et plus tard pour les diagnostics in vitro (DIV), en août 2018.
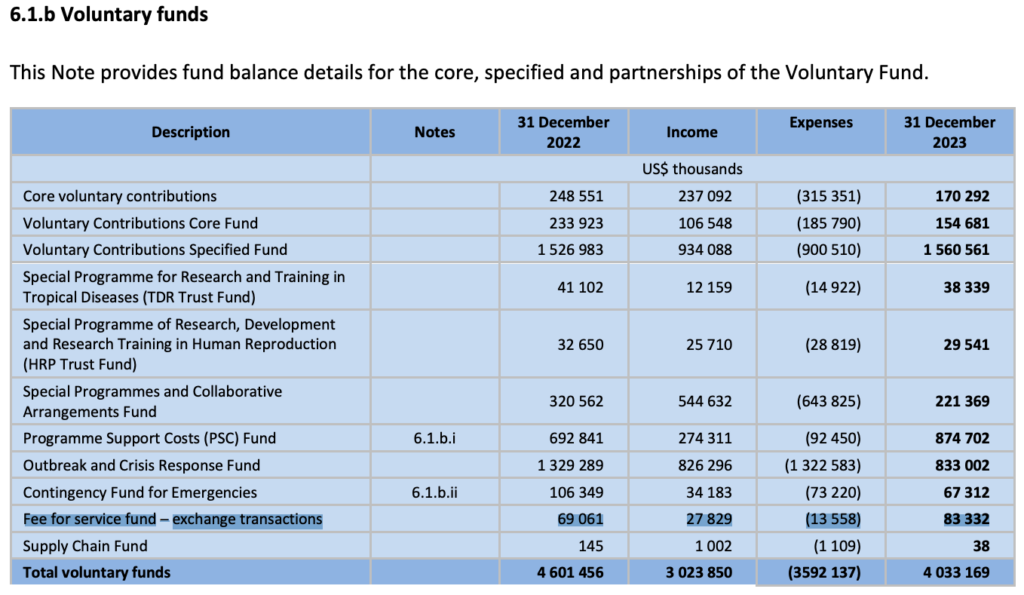
En 2023, le « Fonds de rémunération des services » de l’OMS a réalisé un bénéfice de 14,8 millions de dollars sur les 27,8 millions de dollars de frais qu’il a perçus. Voir https://www.who.int/publications/i/item/A77-20. Avec un exemple p.59: Le Fonds « volontaire » de rémunération des services (Fee for service fund en anglais). Ce fonds a été créé pour enregistrer et déclarer les frais facturés aux fabricants pour les services de préqualification visant à évaluer la qualité, la sécurité et l’efficacité des produits médicaux (vaccins, médicaments ou diagnostics).
OU ENCORE, DANS LE CHAPITRE VACCINS ..
Le processus par lequel les normes et les standards sont évalués par l’OMS pour la préqualification des vaccins n’est PAS soumis à l’avis ou à l’examen du public.
La préqualification des vaccins par l’OMS applique les normes, standards et autres recommandations établis par l’OMS au fur et à mesure qu’ils sont disponibles. Il s’agit notamment des normes élaborées et adoptées par le Comité OMS d’experts de la normalisation biologique, qui portent sur la fabrication, l’homologation, le contrôle de la qualité, l’étiquetage, le transport et le stockage des vaccins.
OU ENCORE, DANS LE CHAPITRE MÉDICAMENTS …
Inscription sur la liste des utilisations d’urgence (Emergency Use Listing en anglais, acronyme EUL)
La procédure d’inscription sur la liste des utilisations d’urgence de l’OMS (EUL) est une procédure fondée sur le risque qui permet d’évaluer et d’inscrire sur la liste des vaccins, des produits thérapeutiques et des diagnostics in vitro non homologués, dans le but ultime d’accélérer la mise à disposition de ces produits aux personnes touchées par une situation d’urgence en matière de santé publique.
L’évaluation déterminera si, à la lumière des normes OMS/internationales disponibles, les données soumises démontrent une probabilité raisonnable que la qualité, la sécurité et l’efficacité du vaccin sont acceptables et que les avantages l’emportent sur les risques prévisibles et les incertitudes dans le contexte d’une urgence de santé publique.
Si des problèmes de qualité et/ou de sécurité sont identifiés après l’inscription, l’OMS peut demander l’avis du groupe consultatif technique pour l’inscription sur la liste des utilisations d’urgence (TAG EUL).
Toutes les informations soumises seront évaluées afin de déterminer si le rapport bénéfice-risque du vaccin reste positif.
(Ah Oui ?? On a vu ce qu’il en était avec les vaccins COVID !!)
Voir le lien https://extranet.who.int/prequal/vaccines/emergency-use-listing-procedure
En quoi l’inscription sur la liste des utilisations d’urgence diffère-t-elle de la préqualification ?
La procédure d’exception est une procédure spéciale pour les vaccins, les médicaments et les diagnostics in vitro non homologués en cas d’urgence de santé publique, lorsque la communauté ou les autorités de santé publique peuvent être disposées à tolérer un degré moindre de certitude quant à l’efficacité et à la sécurité des produits, compte tenu de la morbidité et/ou de la mortalité de la maladie et de l’absence ou de la rareté des options de traitement, de diagnostic/détection ou de prévention. La procédure vise à fournir une liste limitée dans le temps pour les produits non autorisés dans un contexte d’urgence lorsque les données disponibles sont limitées et que les produits ne sont pas encore prêts à faire l’objet d’une demande de préqualification. Dans le cadre de la licence d’utilisateur final, on attend du fabricant qu’il achève le développement du produit et qu’il présente une demande d’autorisation et de préqualification à l’OMS.
L’inscription d’un produit évalué dans le cadre de la procédure d’autorisation universelle de mise sur le marché garantit-elle la sécurité, l’efficacité et les performances du produit ?
L’évaluation des produits dans le cadre de la procédure d’exception est effectuée sur la base des données relatives à la qualité, à la sécurité, à l’efficacité ou aux performances disponibles au moment de la soumission. Toutefois, étant donné que le produit est encore en cours de développement (vaccins et médicaments uniquement, les DIV en cours de développement ne sont pas acceptés pour l’évaluation), la décision d’inscrire le produit sur la liste sera fondée sur une évaluation des risques et des avantages compte tenu de l’urgence en matière de santé publique. Les données disponibles doivent indiquer que l’utilisation du produit apportera un bénéfice à la population cible.
Quelles sont les normes écrites utilisées pour évaluer les nouveaux produits s’il n’existe pas de lignes directrices publiées pour le produit en question ?
Le comité d’évaluation des produits établira une liste des lignes directrices existantes relatives aux vaccins et aux médicaments, ainsi que des données scientifiques publiées susceptibles d’étayer l’évaluation. Cette liste de documents utilisés comme référence sera incluse dans le rapport préparé par le comité d’évaluation des produits.